1. Perhatikan rumus struktur Lewis senyawa NH4Cl berikut:
Ikatan kovalen koordinasi pada gambar tersebut ditunjukkan nomor... (Nomor atom N = 7; H = 1; Cl = 17)
Penyelesaian:
Ikatan kovalen koordinasi adalah ikatan kovalen (ikatan berdasarkan pemakaian pasangan
elektron bersama) di mana pasangan elektron tersebut berasal dari satu unsur saja.
2. Harga keempat bilangan kuantum elektron terakhir dari atom adalah...
A. n = 2; l = 0; m = 0; s = - ½
B. n = 3; l = 1; m = -1; s = -½
C. n = 3; l = 1; m = 0; s = -½
D. n = 3; l = 1; m = 0; s = +½
E. n = 3; l = 1; m = +1; s = +½
Penyelesaian:
Nomor atom S adalah 16 maka konfigurasi elektronnya : 1s2 2s2 2p6 3s2 3p4
n = 3; p => l = 1 ; m = -1; s = - ½ ( )
3.Letak unsur dan konfigurasi elektron yang tepat untuk unsur adalah... (Nomor atom Ar = 18)
Periode Konfigurasi Elektron
A. I A 4 [Ar] 4s1
B. I B 1 [Ar] 4d1
C. IIA 1 [Ar] 4s2
D. II B 2 [Ar] 4d2
E. IV A 3 [Ar] 4s2 3d2
Penyelesaian:
Nomor atom Ar adalah 18 maka konfigurasi elektronnya : [1s2 2s2 2p6 3s2 3p6]
Nomor atom X adalah 19 maka konfigurasi elektronnya : [1s2 2s2 2p6 3s2 3p6] 4s1 [Ar] 4s1
4.Konfigurasi elektron
N = 1s2 2s2 2p3
Cl = 1s2 2s2 2p6 3s2 3p5
Bentuk molekul dari senyawa yang terjadi jika kedua unsur tersebut berikatan susuai aturan oktet adalah...
A.linear
B.segitiga piramida
C.tetrahedral
D.segitiga bipiramida
E. oktahedral
Penyelesaian:
N jumlah elektron valensi 5 untuk mengikuti aturan oktet kurang 3.
Cljumlah elektron valensi 7 untuk mengikuti aturan oktet kurang 1.
Kedua atom akan berbagi elektron untuk dipakai bersama berikatan. N menyumbang masing- masing 1 elektron kepada 1 atom Cl, jadi perlu 3 Cl seperti struktur di atas.
1 atom N, 3 atom Cl, 1 pasang elektron bebas Rumus bentuk molekul AX3E segitiga piramida
5.Perhatikan data sifat fisik dari 2 buah zat berikut!
No Sifat fisik Zat A Zat B
1.Daya hantar listrik lelehan Menghantar listrik Tidak menghantar listrik
2. Daya hantar listrik larutan Menghantar listrik Tidak menghantar listrik
3. Titik didih dan titik leleh Tinggi Rendah
Berdasarkan data tersebut, jenis ikatan yang terdapat pada zat A dan zat B berturut-turut adalah...
A. ion dan kovalen non polar
B. kovalen polar dan kovalen non polar
C. kovalen polar dan koordinasi
D. kovalen polar dan ion E. hidrogen dan ion Penyelesaian:
Senyawa ionik, dalam bentuk lelehan atau larutan mampu menghantarkan listrik serta memiliki
titik didih dan titik leleh relatif tinggi. Senyawa kovalen nonpolar, karena kepolarannya tidak ada maka tidak bisa menghantarkan listrik serta biasanya titik didih dan titik lelehnya relatif rendah.
6. Perhatikan grafik titik didih beberapa senyawa hidrida golongan IV-A, V-A, dan VI-A berikut ini!
Senyawa yang mempunyai ikatan hidrogen antar molekulnya adalah nomor... A. 1 dan 2
B.1 dan 3
C.4 dan 5
D.4 dan 6
E. 5 dan 6
Penyelesaian:
Senyawa yang memiliki ikatan hidrogen biasanya memiliki titik didih relatif tinggi, maka kita
bisa memilih 2 senyawa dengan titik didih yang paling tinggi di antara enam senyawa (6 titik bernomor), yaitu senyawa pada nomor 1 dan 3.
7. Sebanyak 10,8 gram logam aluminium habis bereaksi dengan 9,6 gram oksigen dalam ruang tertutup membentuk aluminium oksida menurut persamaan reaksi:
4Al(s) + 3O2(g) 2 Al2O3(s)
Massa aluminium oksida yang dapat terbentuk sebanyak... ( Ar: Al = 27; O = 16)
A. 3,6 gram
B. 10,8 gram
C. 13,0 gram D. 20,4 gram E. 102,0 gram
Penyelesaian:
Karena habis bereaksi dan reaksi berlangsung dalam wadah tertutup maka sesuai dengan hukum kekekalan massa maka massa aluminium oksida yang terbentuk adalah 10,8 gram + 9,6 gram =
20,4 gram.
8. Sebanyak 2,63 gram hidrat dari kalsium sulfat dipanaskan sampai semua air kristalnya menguap sesuai persamaan reaksi: CaSO4.x H2O(s) CaSO4 + x H2O(g). Jika massa padatan kalsium sulfat yang terbentuk adalah 1,36 gram, rumus senyawa hidrat tersebut adalah... (Ar: Ca = 40; S
= 32; O= 16)
A. CaSO4.3 H2O B. CaSO4.4 H2O C. CaSO4.5 H2O D. CaSO4.6 H2O E. CaSO4.7 H2O Penyelesaian:
Massa molar CaSO4 = 40 + 32 + 64 = 136 g/mol
Massa padatan CaSO4 1,36 g = (1,36/136) mol = 0,01 mol
Berdasarkan perbandingan koefisien maka CaSO4.x H2O juga = 0,01 mol
2,63 gram CaSO4.x H2O = 0,01 mol ; maka massa molar CaSO4.x H2O = 263 g/mol
Massa molar dari CaSO4.x H2O = massa molar CaSO4 + x.massa molar air
= (136 + x.18) g/mol
263 = 136 + x.18
263-136 = x . 18
127 = x . 18
X = 127/18 = 7,06 ~ 7
Jadi rumus senyawa hidrat tersebut adalah CaSO4.7 H2O
9. Aluminium sulfat dibuat dengan cara mereaksikan bauksit dengan asam sulfat. Persamaan reaksi setara yang terjadi pada pembuatan aluminium sulfat adalah...
A. Al + H2SO4 Al2(SO4)3 + H2
B. 2 Al + 3 H2SO4 Al2(SO4)3 + 3 H2
C. Al2O3 + H2SO4 Al2(SO4)3 + H2O
D. Al2O3 + 3 H2SO4 Al2(SO4)3 + 3 H2O E. 2Al2O3 + H2SO4 2Al2(SO4)3 + 3 H2O Penyelesaian:
Bauksit adalah oksida aluminium maka persamaan yang tepat sesuai pernyataan pada soal adalah
Al2O3 + 3 H2SO4 Al2(SO4)3 + 3 H2
10. Perhatikan data percobaan uji larutan berikut!
No Pengamatan pada
Elektroda Lampu
(1) Tidak ada gelembung Padam
(2) Sedikit gelembung Padam
(3) Sedikit gelembung Redup
(4) Banyak gelembung Redup
(5) Banyak gelembung Menyala
Pasangan senyawa yang merupakan larutan elektrolit kuat dan non elektrolit berturut-turut ditunjukkan oleh larutan nomor....
A. (1) dan (3) B. (2) dan (5) C. (4) dan (5) D. (5) dan (1) E. (5) dan (3) Penyelesaian:
Ciri larutan elektrolit kuat jika diuji maka pada elektroda akan banyak gelembung dan lampu
akan menyala terang. Sebaliknya ciri larutan non elektrolit tidak akan di dapati gelembung dan lampu akan padam, karena tidak bisa menghantarkan arus listrik.
11. Larutan Ca(OH)2 0,01 M sebanyak 1 L memiliki pH sebesar...
A. 2 – log 2
B. 2 + log 1
C. 12 – log 2
D. 12 + log 1
E. 12 + log 2
Penyelesaian:
Ca(OH)2 termasuk basa kuat, maka
[OH-] = 2 × [Ca(OH)2]
[OH-] = 2 × 0,01 M = 0,02 M = 2.10-2
pOH = – log [OH-] = – log 2.10-2 = 2 – log 2 pH = 14 – pOH = 14 – (2 – log 2) = 12 + log 2
12. Berikut ini data hasil titrasi larutan CH3COOH dengan larutan Ba(OH)2 0,1 M,
Konsentrasi CH3COOH larutan sebesar...
A. 0,1250 M
B. 0,0625 M
C. 0,2500 M D. 0,6250 M E. 0,6300 M
Penyelesaian:
Volume rata-rata Ba(OH)2 0,1 M adalah 25 mL Jumlah mol Ba(OH)2 = 25 x 0,1 = 2,5 mmol Prinsip titrasi asam lemah oleh basa kuat :
2 CH3COOH + Ba(OH)2 Ba(CH3COO) 2 + 2 H2O
Pada saat mencapai titik ekivalen maka akan terbentuk garam di mana mol CH3COOH dengan mol + Ba(OH)2 sebanding.
Berdasarkan perbandingan koefisien, jumlah mol CH3COOH = 2 x 2,5 mmol = 5 mmol. Karena volume CH3COOH yang digunakan adalah 40 mL maka:
[CH3COOH] = 5 mmol : 40 mL = 0,1250 M
13. Perhatikan data uji pH beberapa larutan!
Larutan
pH Awal pH Setelah Penambahan
Sedikit Asam Sedikit Basa
P 3,0 1,0 4,0
Q 5,0 4,9 5,1
R 8,0 7,9 8,1
S 9,0 8,5 10,5
T 10,0 8,5 11,0
Larutan yang merupakan larutan penyangga adalah...
A. P dan Q B. Q dan R C. R dan S D. R dan T E. S dan T
Penyelesaian:
Dalam larutan penyangga dengan penambahan sedikit asam atau sedikit basa maka pH-nya tidak
banyak mengalami perubahan. Berdasarkan data tersebut maka yang tidak banyak mengalami perubahan pH adalah larutan Q (5,0 4,9 & 5,1) dan R (8,0 7,9 & 8,1)
14. Sebanyak 100 mL KOH 0,04 M dicampur dengan 100 mL HCOOH 0,04 M menurut reaksi: KOH(aq) + HCOOH(aq) HCOOK(aq) + H2O(l)
Jika Ka HCOOH = 2.10–4 dan Kw = 10–14, pH campuran tersebut sebesar...
A. 8 + log √2
B. 8 + log 1
C. 6 – log 1
D. 6 – log √2
E. 2 – log 6
Penyelesaian:
Campuran tersebut akan menghasilkan jenis garam terhidrolisis yang bersifat basa (dari basa
kuat dan asam lemah).
15. Sebanyak 100 mL larutan Pb(NO3)2 0,4 M dicampurkan dengan 100 mL larutan K2SO4 0,4 M.
Jika Ksp PbSO4 = 4.10–8. Massa PbSO4 yang mengendap sebanyak... (Ar: Pb = 207; S = 32; O=
16; K = 39)
A. 12,12 gram B. 24,24 gram C. 30,30 gram D. 60,60 gram E. 303 gram
Penyelesaian:
Massa molar PbSO4 = 303 g/mol
Persamaan reaksi yang terjadi adalah:
Berdasarkan reaksi di atas maka jumlah PbSO4 = 40 mmol = 0,04 mol
Massa PbSO4 = jumlah mol PbSO4 × massa molar PbSO4
= 0,04 mol × 303 gram/mol
= 12,12 gram
16. Perhatikan gambaran molekuler partikel zat terlarut dan pelarut (bukan sebenarnya) pada larutan berikut ini!
Tekanan uap larutan paling besar terdapat pada gambar...
A. 1
B. 2
C. 3
D. 4
E. 5
Penyelesaian:
Dalam pokok bahasan sifat koligatif larutan penambahan zat terlarut akan menurunkan tekanan
uap. Artinya semakin banyak zat terlarut maka tekanan uapnya semakin rendah. Sebaliknya semakin sedikit jumlah zat terlarut tekanannya akan relatif lebih tinggi. Jadi Tabung dengan tekanan paling besar adalah yang memiliki zat terlarut paling sedikit. Tabung 2 memiliki zat terlarut paling sedikit. Jadi jawaban yang tepat adalah B.
17. Beberapa contoh penerapan sifat koligatif larutan dalam kehidupan: (1) Pemberian garam dapur untuk mencairkan salju;
(2) Membuat cairan infus yang akan digunakan pada tubuh manusia; (3) Proses penyerapan air oleh akar tanaman dari dalam tanah;
(4) Penggunaan garam dapur pada pembuatan es putar; dan
(5) Pembuatan ikan asin.
Penerapan sifat koligatif penurunan titik beku larutan adalah nomor....
A. (1) dan (2) B. (1) dan (4) C. (2) dan (3) D. (3) dan (5) E. (4) dan (5)
Penyelesaian:
Penerapan sifat koligatif penurunan titik beku larutan itu antara lain:
- Membuat Campuran Pendingin (Contoh penambahan garam pada pembuatan es putar)
- Antibeku pada Radiator Mobil
- Antibeku dalam Tubuh Hewan
- Antibeku untuk Mencairkan Salju
- Menentukan Massa Molekul Relatif (Mr)
Jadi jawaban yang tepat (1) dan (4)
18. Berikut ini adalah penerapan sifat koloid dalam kehidupan sehari-hari: (1) Pemutihan gula tebu dengan arang tulang;
(2) Langit berwarna jingga pada petang hari;
(3) Penyerapan asap pabrik dengan alat Cottrel;
(4) Proses cuci darah pada penderita gagal ginjal; dan
(5) Penggumpalan karet oleh lateks.
Contoh penerapan sifat adsorpsi terdapat pada nomor...
A. (1) dan (3) B. (2) dan (3) C. (2) dan (4) D. (3) dan (4) E. (4) dan (5)
Penyelesaian:
Cukup jelas.
19. Berikut ini beberapa senyawa turunan benzena yang dapat dimanfaatkan dalam kehidupan: (1) Asam benzoat
(2) Anilina (3) Fenol (4) Stirena
Senyawa yang digunakan untuk pengawet makanan dan desinfektan berturut-turut terdapat pada nomor....
A. (1) dan (3) B. (1) dan (4) C. (2) dan (3) D. (2) dan (4) E. (3) dan (4)
Penyelesaian:
Jelas, asam benzoat (1) banyak digunakan sebagai pengawet makanan; fenol (3) digunakan
sebagai bahan desinfektan.
20. Berikut persamaan reaksi senyawa karbon:
(1) C3H7Cl + NH3 C3H7NH2 + HCl
(2) CH2= CH2+ H2O CH3 – CH2 OH
Jenis reaksi yang terjadi pada persamaan reaksi tersebut berturut-turut adalah....
A. adisi dan substitusi B. adisi dan eliminasi C. substitusi dan adisi
D. substitusi dan eliminasi
E. eliminasi dan adisi
Penyelesaian:
(1) Reaksi substitusi, gugus kloro (–Cl) dengan gugus amina (–NH2)
(2) Reaksi adisi, terjadi pemutusan ikatan ganda menjadi ikatan tunggal dengan masuknya –OH
dan –H
21. Beberapa kegunaan senyawa karbon sebagai: (1) Pemberi aroma;
(2) Pengawet preparat; (3) Bahan bakar;
(4) Pelarut;
(5) Pembersih cat kuku.
Kegunaan dari aseton terdapat pada nomor ....
A. (1) dan (2) B. (1) dan (3) C. (2) dan (3) D. (3) dan (4) E. (4) dan (5)
Penyelesaian:
Kegunaan dari aseton terdapat pada nomor (4) dan (5)
Aseton digunakan sebagai pelarut senyawa organik, untuk pembersih cat kuku dan berbagai zat warna organik lainnya.
22. Suatu senyawa dengan rumus umum CnH2nO dapat dioksidasi menjadi asam karboksilat dan membentuk endapan merah bata jika direaksikan dengan pereaksi Fehling. Senyawa tersebut memiliki gugus fungsi....
A. – O –
B. – OH
C. – CHO D. – COOH E. – CO –
Penyelesaian:
Senyawa yang jika dioksidasi menjadi asam karboksilat dan membentuk endapan merah bata
ketika direaksikan dengan pereaksi Fehling adalah senyawa golongan aldehid. Gugus fungsi aldehid adalah – CHO
Aldehid Asam karboksilat
23. Berikut tabel yang berisi data polimer, monomer, proses pembentukan, dan kegunaannya:
No Polimer Monomer Proses Pembuatan Kegunaan
(1) Teflon Tetraflouroetilena Adisi Pelapis panci
(2) Amilum Propena Kondensasi Adonan kue
(3) PVC Vinil Klorida Adisi Plastik
(4) Karet alam Etena Kondensasi Ban
(5) Protein Isopropena Kondensasi Serat sintesis
Pasangan data yang keempatnya berhubungan secara tepat adalah....
A. (1) dan (2) B. (1) dan (3) C. (2) dan (3) D. (3) dan (5) E. (4) dan (5)
Penyelesaian:
Hubungan secara tepat dari data diatas seharusnya:
No Polimer Monomer Proses Pembuatan Kegunaan
(1) Teflon Tetraflouroetilena Adisi Pelapis panci
(2) Amilum Glukosa Kondensasi Adonan kue
(3) PVC Vinil Klorida Adisi Plastik
(4) Karet alam Isoprena Adisi Ban
(5) Protein Asam amino Kondensasi Zat pembangun
24. Pasangan data yang berhubungan dengan tepat adalah....
Bahan makanan Jenis Karbohidrat Hasil identifikasi
A Glukosa Hasil uji Fehling menghasilkan ester dan Cu2O
B Galaktosa Tidak terbentuk warna merah-ungu saat uji Molisch
C Amilum Hasil uji Fehling menghasilkan Cu2O
D Selulosa Diperoleh dari hidrolisis amilum dengan enzim
E
Sukrosa Direaksikan dengan tes Fehling tidak
menghasilkan Cu2O
Penyelesaian:
Jawaban E cukup jelas
25. Perhatikan kegunaan bahan makanan dalam tubuh! (1) Biokatalis
(2) Sumber energi primer
(3) Zat pembangun
(4) Pelarut vitamin
Fungsi dari protein ditunjukkan pada nomor....
A. (1) dan (4) B. (1) dan (3) C. (2) dan (3) D. (2) dan (4) E. (3) dan (4)
Penyelesaian:
Fungsi protein (sebagai bahan makanan) dalam tubuh antara lain:
- Enzim yang tersusun dari protein berfungsi sebagai biokatalis.cadangan energi tubuh;
- Sebagai zat pembangun tubuh
- Sebagai zat pengatur.
- sebagai sumber dari zat-zat yang penting untuk pertumbuhan
- pemeliharaan jaringan tubuh.
26. Diketahui reaksi pembentukan HBr sebagai berikut:
½ H2(g) + ½ Br2(g) HBr(g) ∆H = -55 kJ.mol-1
Diagram tingkat energi reaksi tersebut adalah...
Jawaban A. Cukup jelas
27. Diagram entalpi tahap-tahap reaksi ditunjukkan oleh bagan sebagai berikut:
kJ
2 S(g) + 3 O2(g)
H1
2 SO2
(g) + 3 O2(g)
H3 = – 790,4 kJ.mol–1
Harga ∆H1 sebesar....
A. –593,8 kJ.mol-1
B. –296,9 kJ.mol-1
C. +296,9 kJ.mol-1
D. +593,8 kJ.mol-1
E. +790,4 kJ.mol-1
H2 = –196,6 kJ.mol–1
2SO3(g)
Penyelesaian:
Dari diagram dapat ditentukan rumus termokimia:
∆H1 = ∆H3 – ∆H2
∆H1 = –790,4 kJ/mol – (–196,6 kJ/mol)
∆H1 = –593,8 kJ/mol
28. Diberikan data hasil reaksi logam X dengan HCl 1 M sebagai berikut:
Laju reaksi pembentukan gas H2 pada suhu 27oC adalah....
A. 1,20 mL.det-1
B. 1,25 mL.det-1
C. 1,50 mL.det-1
D. 2,40 mL.det-1
E. 3,00 mL.det-1
Penyelesaian:
Dari data laju reaksi pada soal ini hanya dipengaruhi oleh faktor volume (konsentrasi) dan tidak
dipengaruhi oleh suhu.
Dengan memperhatikan 2 data kita bisa menentukan laju reaksi pembentukan gas H2. Laju reaksi pembentukan gas H2 = perubahan volume gas H2 : perubahan waktu
= (15 – 0) mL : (12 – 0) detik
= (15 : 12) mL/detik
= 1,25 mL/detik
29. Perhatikan reaksi CaCO3 dengan larutan HCl 2 M berikut!
Massa CaCO3 untuk seluruh larutan sama. Laju reaksi percobaan yang hanya dipengaruhi oleh luas permukaan terdapat pada nomor ....
A. (1) terhadap (2) B. (1) terhadap (5) C. (1) terhadap (4)
D. (2) terhadap (4)
E. (2) terhadap (5)
Penyelesaian:
Dari gambar pada soal ini bisa ditafsirkan bahwa gambar no (2) dan (4) hanya dipengaruhi oleh
luas permukaan saja, sementara nomor (1), (3), akan dipengaruhi oleh pengadukan dan suhu, (5) dipengaruhi oleh pengadukan. Dengan catatan bahwa batang yang tertampil itu adalah benar batang pengaduk
30. Pada reaksi kesetimbangan:
2 NO(g) + O2(g) N2O4(g) ∆H = –a kJ Jika suhu dinaikkan, yang akan terjadi adalah....
A. Kesetimbangan akan bergeser ke kiri karena proses reaksi eksoterm
B. Kesetimbangan akan ke kanan karena ∆H = –a kJ
C. Laju rekasi ke kanan bertambah besar karena ∆H = –a kJ D. Kesetimbangan tetap karena koefisien pereaksi lebih besar E. N2O4 bertambah karena koefisien lebih kecil
Penyelesaian:
Terkait pergeseran kesetimbangan yang disebabkan perubahan suhu, maka yang perlu diperhatikan adalah apakah reaksi itu bersifat eksoterm atau endoterm. Pada reaksi endoterm ketika suhu ditingkatkan akan menambah jumlah hasil reaksi, sebaliknya pada reaksi eksoterm peningkatan suhu justru akan menyebabkan hasil reaksi jumlahnya semakin sedikit, pereaksi jumlahnya akan semakin banyak.
31. Pada reaksi kesetimbangan CO(g) + 3H2(g) CH4(g) + H2O(g) diperoleh data sebagai berikut. Harga Kc dari reaksi tersebut ....
Penyelesaian:
Kc dari reaksi dan dengan data konsentrasi zat-zat yang terlibat dapat ditentukan dengan rumus:
32. Perhatikan persamaan reaksi berikut: (1) IO3– IO4–
(2) Ca Ca2+ + 2e– (3) Zn2+ + 2e– Zn (4) NO3– NO
Persamaan reaksi oksidasi terdapat pada nomor....
A. (1) dan (2) B. (1) dan (3) C. (2) dan (3) D. (2) dan (4) E. (3) dan (4)
Penyelesaian:
Ciri-ciri reaksi oksidasi adalah dengan ditandai adanya elektron di ruas kiri dari persamaan reaksi, atau adanya peningkatan bilangan oksidasi, atau ditandai dengan bertambahnya jumlah atom O.
Reaksi (1) bilangan oksidasi I berubah dari +5 menjadi +7 atau lihat jumlah atom O bertambah kan?!
Reaksi (2) reaksi ini melepaskan elektron. Jawaban yang tepat adalah A.
33. Perhatikan persamaan reaksi yang terjadi pada sel aki berikut ini!
Pb(s) + a PbO2(s) + b H2SO4(aq) → 2 PbSO4(s) + c H2O(l)
Harga koefisien a,b, dan c berturut-turut adalah....
A. 1, 1, dan 2
B. 1, 2, dan 1
C. 1, 2, dan 2
D. 2, 1, dan 1
E. 2, 2, dan 1
Penyelesaian:
Sebenarnya ini adalah reaksi redoks, namun dari persamaan yang disajikan dengan mudah untuk ditebak harga koefisiennya, reaksi setaranya adalah:
Pb(s) + PbO2(s) + 2 H2SO4(aq) 2 PbSO4(s) + 2 H2O(l)
34. Beberapa data harga potensial reduksi standar (Eo) berikut:
35. Proses elektrolisis lelehan NaCl dengan elektroda karbon, digunakan arus sebesar 10 ampere selama 30 menit. Massa logam natrium yang diperoleh adalah...
(Ar: Na = 23, Cl = 35,5)
Penyelesaian:
Elektrolisis lelehan NaCl
W = (e.i.t)/96500 ; di mana e = Ar Na/ elektron valensi Na ( 23/1) W = (23 ×10 ampere × 30 menit × 60 detik/menit)/96500
W = (23 ×10 × 30 × 60 )/96500 → Jawaban A.
36. Berikut ini adalah percobaan tentang korosi besi :
Proses korosi yang paling lambat terjadi pada gambar nomor...
A. (5) B. (4) C. (3) D. (2) E. (1)
Penyelesaian:
Paku akan lambat berkatar jika terlindung dari udara terbuka yang lembab (mengandung uap
air). Dalam minyak tanah yang tidak bisa bercampur dengan air maka dimungkinkan dapat melindunginya dari oksigen dan air.
37. Berikut ini beberapa sifat unsur: (1) Reduktor kuat;
(2) Mudah membentuk ion dengan muatan -1; (3) Bereaksi dengan membentuk basa kuat;
(4) Umumnya berwujud gas.
Sifat unsur golongan alkali terdapat pada nomor....
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)
Penyelesaian:
Kombinasi sifat-sifat unsur golongan alkali dari alternatif yang disediakan adalah 1 dan 3, cukup
jelas.
38. Perhatikan beberapa sifat zat berikut! (1) Mudah meleleh;
(2) Memiliki inti yang tidak stabil;
(3) Memiliki energi ionisasi yang tinggi; (4) Dapat mengalami peluruhan.
Sifat zat radioaktif terdapat pada nomor....
A. (1) dan (2)
B. (1) dan (4)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)
Penyelesaian:
Kombinasi sifat-sifat zat radioaktif dari alternatif yang disediakan adalah:
Intinya tidak stabil & dapat mengalami peluruhan.
39. Beberapa senyawa berikut mengandung unsur golongan alkali tanah: (1) MgCO3
(2) BaSO4
(3) MgSO4
(4) SrSO4
(5) CaO
Senyawa yang dimanfaatkan untuk bahan bangunan terdapat pada nomor....
A. (1) B. (2) C. (3) D. (4) E. (5)
Penyelesaian:
Senyawa yang secara langsung digunakan sebagai bahan bangunan adalah batu gamping
(kapur) yang di dalamnya mengandung CaO.
40. Berikut ini beberapa proses pengolahan logam: (1) Down;
(2) Tanur tiup; (3) Ekstraksi; (4) Wohler;
(5) Hall-Heroult.
Pengolahan besi menggunakan proses yang ditunjukkan oleh nomor....
A. (1)
B. (2)
C. (3)
D. (4)
E. (5)
41. Konfigurasi elektron unsur Q yang paling
sesuai adalah….
Q
Konsfigurasi electron unsur Q yang paling
sesuai adalah….
A. 1s2 2s2 2p6 3s2 3p6 3d10 4p3
B. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p1
C. 1s2 2s2 2p6 3s2 3p6 4s2 4p6 5s2 5p3
D. 1s2 2s2 2p6 3s2 3p6 4s2 4p6 3d5
E. 1s2 2s2 2p6 3s2 3p6 4s2 3d10 5s1
Jawaban: B
Pembahasan:
IA IIA IIIA IVA VA VIA VIIA VIIIA
Q terletak pada golongan IIIA pada periode 4 maka konfigurasi nya adalah.
Q = 2 8 18 3
Q = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p1
Konfigurasi berdasarkan urutan kulit adalah.
Q = 1s2 2s2 2p6 3s2 3p6 3d104s2 4p1
Informasi berikut ini digunakan untuk mengerjakan soal nomor 2 dan 3
Dua buah unsur mempunyai diagram orbital sebagai berkut:
X [Ar]
Y [Ne]
42. Nomor atom unsur X adalah….
A. 17
B. 18
C. 21
D. 26
E. 30
Jawaban: C Pembahasan:
Unsur X mempunyai nomor atom 21 (Ar=18 + 3= 21)
43. Unsur Ydalam system periodik terletak pada
golongan dan periode berturut turut ….
A. IIIA, 3
B. IIIB, 4
C. VA, 3
D. VIIA, 3
E. VIIB, 4
Jawaban: D Pembahasan:
Neon Memiliki nomor atom 10, maka nomor atom Y
adalah 10 + 7 = 17 maka konfigurasi atom Y adalah
17Y = 2 8 7 (golongan VIIA periode 3)
44. Pada reaksi antara logam tembaga sebanyak12 gramdengan 4 gram gas oksigen sesuai persamaan reaksi:
2Cu (s) + O2 (g) 2CuO (s)
Ternyata dari percoban dihasilkan 15 gram
tembaga (II) oksida dan sisa gas oksigen sebanyak 1 gram,kenyataan ini sesuai hokum…. (Ar Cu = 64, O=16)
A. Dalton
B. Lavoisier
C. Proust
D. Gay lussac
E. Boyle
Jawaban: B Pembahasan: Cukup jela
45. Perhatikan data percobaan uji larutan berikut:
Pasangan senyawa yang merupakan larutan elektrolit kuat dan elektrolit lemah berturut turut adalah larutan nomor….
A. 1 dan 4
B. 2 dan 3
C. 2 dan 4
D. 4 dan 3
E. 5 dan 4
Jawaban: D Pembahasan:
Data 1 elektrolit lema
Data 2 non elektrolit
Data 3 elektrolit lemah
Data 4 elektrolit kuat
Data 5 non elektrolit
46. Sebuah logam besi ingin disepuh dengan emas. Untuk itu dilakukan proses elektrolisis dengan larutan AuCl3 selama 1 jam dan arus
10A. massa emas yang mengendap di katoda adalah….. (Ar= Au=197)
197 x 1 x 96.500 x 10
A.
3 x 60 x 60
197 x 1 x 96.500
B.
3 x 60 x 60
197 x 10 x 60 x 60
C.
3 x 96.500
197 x 10 x 60 x 96.500
D.
3 x 60
3 x 60 x 60
E.
3 x 96.500 x 197
Jawaban: C
W = e I t / 96500
= 197 / 3 . 10 . 1. 60 .60 / 96500
= 197 . 10 .60. 60 / 96500 . 3
47. Berikut ini kegunaan senyawa benzena
(1) bahan baku pembuatan aspirin
(2) bahan baku asam benzoat
(3) pembuatan plastik
(4) bahan peledak
(5) antiseptik
Kegunaan toluene adalah…
A. 1 dan 2
B. 1 dan 3
C. 2 dan 3
D. 2 dan 4
E. 4 dan 5
Jawaban: D Pembahasan:
Kegunaan toluene adalah sebagai bahan peledak dan
bahan pembuat asam benzoate
48. Data tentang koloid yang tepat adalah….
Fase
terdispersi Medium
Pendispersi
Jenis koloid
A Padat Cair Emulsi
B Cair Gas Sol
C Gas Cair Gel
D Gas Padat Busa padat
E Padat Padat aerosol
Jawaban: D
Padat dalam cair adalah sol
Cair dalam gas adalah aerosol
Gas dalam cair adalah buih
Gas dalam padatan adalah busa padat
Padat dalam padat adalah sol padat
49. Pasangan data yang berhubungan secara tepat
adalah…
Sifat Koloid Penerapan dalam
kehidupan sehari hari
A Koloid
pelindung Penambahan tawas pada
penjernihan air
B Dialysis Mesin pencuci darah
C Efek tyndall Penyaringan asap pabrik
D Koagulasi Menghilangkan bau
Badan
E Adsorpsi Gelatin pada es krim
Jawaban: B Pembahasan:
Penambahan tawas (adsorpsi)
Mesin cuci darah (dialysis)
Penyaringan asam pabrik (elektroforesis) Penghilang bau badan (adsopsi)
Gelatin pada es (koagulasi)
50. Perhatikan rumus struktur senyawa karbon berikut:
O
(1) CH3- C – CH2- CH3
(2) CH3- CH2 - CH - CH3
OH
Nama IUPAC dari rumus struktur (1) dan (2)
berturut turut adalah….
A. 1 – butanol dan butanal
B. 1 – butanol dan 2 butanon
C. 2 – butanol dan 2-butanon
D. 2 –butanon dan 1- butanol
E. 2-butanon dan 2- butanol
Jawaban: E Pembahasan:
Senyawa I adalah gugus keton Maka nama yang tepat
adalah 2 butanon
Senyawa II gugus alcohol maka nama yang tepat adalah 2 butanol


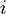 , dilambangkan dengan
, dilambangkan dengan 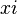 adalah jumlah mol komponen
adalah jumlah mol komponen  adalah
adalah  dan seterusnya. Jumlah fraksi mol dari semua komponen adalah 1. Persamaannya dapat dituli
dan seterusnya. Jumlah fraksi mol dari semua komponen adalah 1. Persamaannya dapat dituli

 P0 - P
P0 - P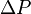 = P0 x Xt
= P0 x Xt )
)
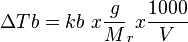

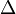 Tb = kenaikan titik didih
Tb = kenaikan titik didih



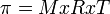
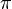 = tekanan osmotik
= tekanan osmotik
